Commercializzato da Sigma-Tau il farmaco orfano è stato sviluppato in collaborazione con il NIH e con alcuni network di pazienti e ricercatori
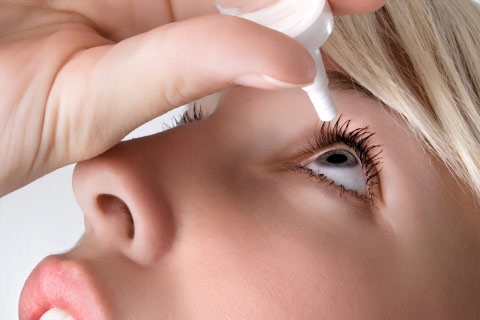
ROMA – L’azienda americana Sigma-Tau Pharmaceuticals, una divisione del business globale “ Malattie Rare” del Gruppo Sigma-Tau, ha annunciato l’immissione in commercio negli Stati Uniti del CYSTARAN (soluzione oftalmica di cisteamina) per il trattamento dei depositi di cristalli di cistina nella cornea in pazienti affetti da cistinosi. Si tratta della prima terapia (e l’unica approvata dalla FDA, Food and Drug Administration), sviluppata in associazione con il NIH (National Institutes of Health) e in collaborazione con la Cystinosis Foundation, CystinosisResearch Foundation e CystinosisResearch Network. La FDA, che aveva già valorizzato il prodotto riconoscendogli lo status di “farmaco orfano”, ha approvato il CYSTARAN lo scorso ottobre.
“Il lancio del CYSTARAN rappresenta una notevole pietra miliare per il Gruppo italiano Sigma-Tau e dà ulteriore prova della nostra consolidata capacità di sviluppare e rendere disponibili terapie nuove per i pazienti affetti da diverse malattie rare – ha commentato Dave Lemus, Amministratore Delegato della Sigma-Tau Pharmaceuticals – siamo impegnati a garantire l’accesso completo a tutti i pazienti affetti da cistinosi con accumulo di cristalli di cistina nella cornea. È per noi un grande privilegio poter offrire questa importante nuova terapia che avrà effetti positivi sulla vita quotidiana di questi pazienti.”
La malattia causa ipertiroidismo, diabete, epatosplenomegalia con coinvolgimento muscolare e cerebrale, lacrimazione e fotofobia. Proprio per questo farmaco Il Gruppo Sigma-Tau ha ottenuto il riconoscimento ufficiale, durante la celebrazione del trentesimo anniversario, della National Organization for Rare Disorders (NORD) statunitense.
“Sigma-Tau ha dimostrato ancora una volta il suo impegno forte e duraturo al servizio dei pazienti affetti da malattie rare – ha dichiarato Peter L. Saltonstall, Presidente e ChiefExexutive di NORD – con prodotti innovativi e programmi di ricerca efficaci”.
Sigma-Tau è già in avanzata fare di pianificazione per sottomettere la “orphan drug designation” anche in altri Paesi, inoltre CYSTARAN sarà comunque disponibile, nell’ambito di programmi speciali (named patient use), per i pazienti sia in Europa che in Asia.