Acronimo di Clustered Regularly Interspaced Short Palindromic Repeats, questa terapia, ancora sperimentale, promette nuovi traguardi
È passato più di un anno da quando Markus Mapara, ematologo, oncologo e direttore nel reparto di trapianto di sangue e midollo, presso la Columbia University Irving Medical Center di New York, ha utilizzato per la prima volta un trattamento sperimentale di modifica genica CRISPR in un paziente con anemia falciforme, una malattia ereditaria del sangue che può causare danni agli organi e morte prematura.
Sebbene la sperimentazione clinica sia ancora in fase iniziale ed è stata testata solo su pochi pazienti, i risultati sono davvero promettenti.
“Il paziente trattato sta reagendo bene”, ha detto Mapara, “e non ha avuto una sola crisi”.
L’anemia falciforme, che attualmente colpisce milioni di persone in tutto il mondo, è il risultato di una mutazione genetica che produce un tipo anomalo di emoglobina, la proteina che i globuli rossi utilizzano per fornire ossigeno in tutto il corpo. Le cellule anormali assumono una forma a falce, o curva, che può coagularsi all’interno di vasi sanguigni stretti. Un effetto che crea enormi problemi a chi ne è colpito.
Al momento l’unica opzione curativa è il trapianto di midollo osseo da un donatore sano ma questo approccio può avere gravi complicazioni.Poichè si rischia
di introdurre cellule estranee in un ricevente con le conseguenze di rigetto.
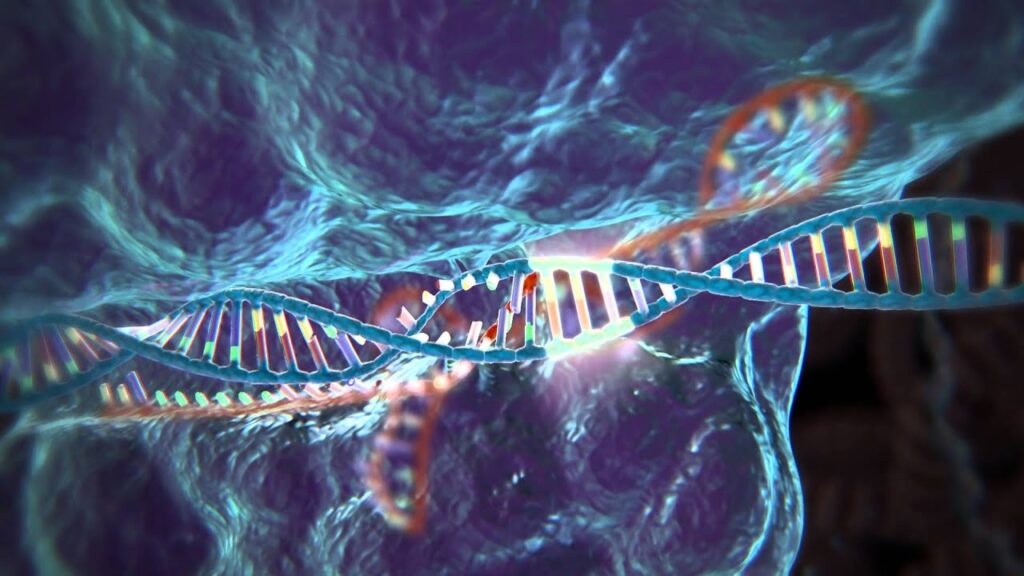
Ma con lo sviluppo di CRISPR si sono aperte nuove opportunità di trattamento utilizzando le cellule dei pazienti stessi.
CRISPR è uno strumento che scienziati e medici di tutto il mondo stanno utilizzando per comprendere la genetica di tutti gli esseri viventi e, soprattutto, per intervenire nelle malattie genetiche.
CRISPR è stato sviluppato da due scienziati, Jennifer Doudna, (a sinistra nella foto) professoressa di Chimica Molecolare presso il Dipartimento di Chimica e Ingegneria Chimica dell’Università della California a Berkeley e Emmanuelle Charpentier biochimica, genetista e microbiologa francese, membro dell’Accademia delle scienze e dell’Accademia delle tecnologie. Le due scienziate nel 2020 hanno ricevuto il Premio Nobel 2020 per la chimica proprio per i risultati raggiunti su questa tecnologia.

Entrambe hanno lavorato insieme per scoprire con precisione come si sono evoluti i batteri per combattere i virus e per applicare lo stesso processo per ingegnerizzare le cellule umane. In particolare, Doudna e Charpentier hanno scoperto che un enzima noto come Cas9 può essere guidato da un RNA programmabile per localizzare sequenze genetiche specifiche in qualsiasi organismo.
L’enzima funziona quindi come un paio di forbici, tagliando la doppia elica del DNA e consentendo di eliminare, aggiungere o sostituire le sequenze. È uno strumento che scienziati e clinici di tutto il mondo stanno utilizzando per comprendere la nostra genetica e intervenire sulle malattie genetiche.
La tecnologia è stata accolta positivamente da tutta la comunità scientifica come un progresso significativo che sta cambiando il modo in cui viene svolta la ricerca in tutti i campi. CRISPR è stato utilizzato per sperimentare zanzare modificate geneticamente, per ridurre la diffusione della malaria, per l’ingegneria agricola, per resistere ai cambiamenti climatici e, negli studi clinici sull’uomo, per trattare una serie di malattie, dal cancro all’amiloidosi da transtiretina, una rara malattia proteica che devasta nervi e organi.
Tuttavia, la tecnologia ha implicazioni etiche significative, inclusa la garanzia che non abbia conseguenze negative indesiderate, che sia utilizzata in modo equo e che venga raggiunto un consenso su dove tracciare una linea di demarcazione sull’uso di questa dirompente tecnologia.
Mapara è stato uno dei primi a tentare di utilizzare CRISPR per trattare una malattia genetica nell’uomo. Sebbene ricercatori e medici stiano perseguendo diversi trattamenti di terapia genica per l’anemia falciforme e la beta talassemia, una malattia del sangue simile, questo approccio prende di mira il gene che interrompe la produzione di emoglobina fetale. Gli esperti hanno scoperto che le persone producono emoglobina fetale fino a circa tre mesi dopo la nascita, dopo di che le loro cellule iniziano a produrre emoglobina adulta. È l’emoglobina adulta nelle persone con anemia falciforme e beta talassemia che assume la forma irregolare.
Lo studio di Mapara è davvero sorprendente. I risultati iniziali della sperimentazione clinica sono stati pubblicati nel dicembre 2020 e quelli del follow-up continuano a essere molto promettenti.
“Siamo a un punto di svolta per quei pazienti”, dice Mapara. Ma non è l’unico ad aver raggiunto risultati clinici promettenti.
CRISPR infatti è stato utilizzato anche in uno studio clinico finalizzato al trattamento dell’amaurosi congenita di Leber, una forma progressiva genetica che determina una perdita della vista.
Sebbene ci siano più di 300 geni collegati a difetti della vista, questo studio si è concentrato su una mutazione genetica che causa una forma particolarmente grave di degenerazione, ovvero un problema con lo splicing dell’mRNA.
L’occhio è una delle parti più accessibili del cervello e la vista è una cosa così importante per le persone. Questo, come ha confermato Mark Pennesi, professore all’Oregon Health & Science University School of Medicine, apre davvero la porta a molte altre terapie.
I risultati iniziali dello studio clinico che ha coinvolto sei pazienti mostrano che la procedura è sicura e che potrebbe decisamente migliorare la loro vista.
Un paziente curato nel nostro ospedale ha avuto un miglioramento dell’acuità visiva, può vedere gli oggetti e sente che sta effettivamente vedendo i colori.
E non è tutto. CRISPR sta suscitando scalpore anche nel campo del trattamento del cancro. All’Università della Pennsylvania a Filadelfia, medici e ricercatori hanno utilizzato CRISPR per ingegnerizzare geneticamente le cellule immunitarie per combattere meglio i tumori.ù

Edward Stadtmauer, professore di neoplasie ematologiche presso la Perelman School of Medicine dell’Università della Pennsylvania e ricercatore nella sperimentazione clinica, ha iniziato a lavorare a questo progetto intorno al 2016, quando la tecnologia CRISPR era molto nuova.
Stadtmauer ha lavorato a lungo con la terapia con cellule T CAR, che modificano le cellule T immunitarie. Sebbene questo metodo sia stato estremamente efficace con molti tumori del sangue, Stadtmauer ha ipotizzato che CRISPR potrebbe portare il trattamento al livello successivo.
Utilizzando la tecnologia, Stadtmauer e il suo team sono stati in grado di prendere le cellule T del paziente, rimuovere tre geni e aggiungere un gene che, insieme, ha allungato la vita della cellula immunitaria e le ha rese più potenti nel colpire il cancro. È stato il primo uso sperimentale di modifiche multiple con CRISPR per alterare il genoma umano.
Insomma , questa tecnologia è davvero potente, anche se c’è molta ricerca ancora da fare.